المحلول عبارة عن خليط متجانس يتكون من مادتين أو أكثر ، بينما القابلية للذوبان هي أقصى كمية لمركب أو مادة يمكن أن تذوب في عدد من المذيبات .
نواجه أنواعًا عديدة من الحلول في الحياة اليومية ، بما في ذلك كوب من الشراب الحلو. يوجد في كوب من الشراب عدة مكونات ، وهي الماء والشراب والسكر.
إذا تم خلط هذه المكونات معًا حتى تختفي المكونات المكونة ، يصبح حلاً.
بمناقشة الحل ، تتضمن المراجعة الإضافية التالية تعريف الحل وخصائصه وأنواعه وعوامله.
تعريف الحل والذوبان

المحلول
المحلول عبارة عن خليط متجانس يتكون من مادتين أو أكثر. يسمى الحل بسبب المكونات المكونة للحل.
يوجد في المحلول مذيبات ومذابات. المذاب (المذاب) هو مادة تشكل محلولًا يحتوي على كمية أقل في المحلول. وفي الوقت نفسه ، المذيب (المذيب) مادة أكثر وفرة من المذاب.
يتم التعبير عن تكوين المادة البحرية في المحلول بتركيز المحلول. بينما تسمى عملية خلط المذاب والمذيب لتشكيل محلول الذوبان أو الذوبان.
لفهم المزيد حول الحل ، ضع في اعتبارك الصورة التوضيحية التالية.
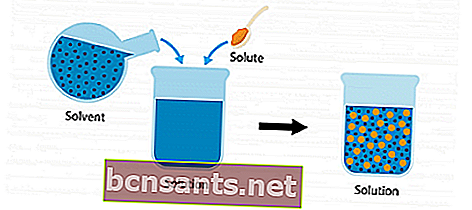
يوجد مذاب ومذيب. عندما يتم خلط المكونين ودمجهما في وعاء ، يصبح حلاً.
الذوبان (ق)
معنى الذوبان هو أقصى كمية من المركب أو المادة التي يمكن أن تذوب في عدد من المذيبات.
يُرمز إلى القابلية للذوبان بواسطة s (القابلية للذوبان) بوحدات مول / لتر أو تستخدم وحدات مولارية م.
م = ن / ف
حيث M هي المولارية (مول / لتر) ، ن هو عدد مولات المادة (مول) ، و V هو حجم المحلول أو المذيب (L).
تُعرَّف القابلية للذوبان أيضًا على أنها تركيز مادة يمكن أن تذوب في كمية معينة من المذيب.
منتج الذوبان الثابت (Ksp)
سيشكل المذاب المذاب في مذيب تفاعل توازن. يتأثر حدوث التوازن بالمذابات غير القابلة للذوبان والأيونات المذابة.
اقرأ أيضًا: 100+ أمثلة للكلمات القياسية وغير القياسية + التفسيرات [محدّثة]فيما يلي مثال على ثابت التوازن للتفاعل.
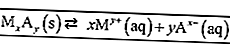
وفقًا لقواعد كتابة معادلة التوازن ، تتم كتابة المواد في شكل محلول (aq) والغاز (الغازات) فقط في الصيغة. بحيث يتم الحصول عليها:
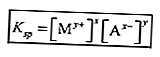
يسمى ثابت التوازن للحل الذي يصعب إذابته بثابت منتج الذوبان (Ksp).
خصائص الحل

تنقسم الخواص الفيزيائية التي تظهر في المحلول إلى ثلاث وهي:
1. الخصائص التجميعية للحلول
هي طبيعة المحلول الذي يعتمد على عدد الجزيئات المذابة في المحلول ولا يعتمد على نوع جزيئات المذيب.
تعادل الخواص التجميعية تركيز العديد من المواد غير المنحل بالكهرباء في المحلول بغض النظر عن النوع أو الخواص الكيميائية للمكونات.
عند تحديد الخواص الترابطية لمحلول المواد الصلبة في سائل ما ، تعتبر المادة الصلبة غير متطايرة وضغط البخار فوق المحلول يأتي بالكامل من المذيب.
بعض الخصائص التجميعية للمحلول هي الضغط الاسموزي ، وانخفاض ضغط البخار ، وزيادة نقطة الغليان ، وانخفاض نقطة التجمد.
2. خصائص مضافة
في المحلول ، الخصائص المضافة هي خصائص المحلول الذي يعتمد على مجموع الذرات في الجزيء أو على عدد الخصائص المكونة للمحلول.
مثال على الخصائص المضافة للحلول هو الوزن الجزيئي ، وهو مجموع الكتل الذرية.
يتم تضمين كتلة مكونات المحلول في الخواص المضافة ، والكتلة الإجمالية للمحلول هي مقدار كل مكون من مكونات المحلول ، أي المذاب والمذيب.
3. الطبيعة التأسيسية
يتضمن ذلك طبيعة المحلول الذي يعتمد على ذرات الجزيء (على نوع الذرة وعدد الذرات). تشير خصائصه التأسيسية إلى قواعد المركبات الفردية ومجموعات الجزيئات في النظام.
هناك العديد من الخصائص الفيزيائية التي تعتبر مضافة جزئياً وتكوينها. من بينها انكسار الضوء ، والخصائص الكهربائية ، والخصائص السطحية والسطوح التي يتم تضمينها في بعض المواد التأسيسية وبعض المواد المضافة.
نوع الحل

1. محلول غير مشبع
يتم تعريف المحلول غير المشبع على أنه محلول يحتوي على نسبة مذابة أقل مما هو ضروري لصنع محلول مشبع. تحتوي المحاليل غير المشبعة على جزيئات لم تتفاعل بشكل صحيح مع المادة ، وبعبارة أخرى يمكنها إذابة المادة.
يُقال أن المحلول غير مشبع عندما تكون قيمة تركيز الأيونات <Ksp. في محلول غير مشبع لا يوجد ترسيب مذاب.
اقرأ أيضًا: تعريف المحاليل الكيميائية وأنواعها ومكوناتها2. محلول مشبع
يتم تضمين محلول في محلول مشبع عندما يكون هناك توازن بين المذاب والمذيب. في محلول مشبع ، تتفاعل الجسيمات تمامًا مع الكاشف أو تختبر أقصى تركيز.
يُقال أن المحلول مشبع إذا كان تركيز الأيونات هو نفس قيمة Ksp. في حالة التوازن هذه ، تكون سرعة المذاب في المذيب هي نفسها السرعة التي يستقر بها. أي أن تركيز المادة في المحلول هو نفسه.
3. محلول مشبع للغاية
هذا محلول يحتوي على مذاب أكثر من المذيب. يتسبب هذا في قيمة المنتج لتركيز الأيونات> Ksp بحيث يتشبع المحلول ويستقر.
عامل الذوبان

تختلف قابلية ذوبان السائل. يتأثر هذا بالعديد من عوامل الذوبان. فيما يلي بعض عوامل الذوبان.
1. درجة الحرارة
يؤثر مستوى درجة حرارة المحلول على عملية الذوبان المذاب. في درجات حرارة أعلى ، يذوب المذاب بسهولة في المذيب.
يحدث هذا لأن الجسيمات الصلبة في درجات حرارة أعلى تتحرك بشكل أسرع ، مما يسمح بتصادمات أكثر تكرارًا وفعالية.
2. حجم المذاب
كلما كانت الحبيبات المذابة أصغر ، كلما كان من الأسهل إذابتها في المذيب. تؤدي الكمية الصغيرة من الحبيبات الذائبة إلى اتساع مساحة سطح المادة وانتشارها في محلول.
كلما كبرت مساحة سطح المادة ، كلما اصطدمت الجسيمات ببعضها البعض. هذا ما يجعل عملية الذوبان تتم بشكل أسرع.
3. حجم المذيبات
يؤثر الحجم الكبير للمذيب على عملية إذابة المادة. هذا لأن المزيد والمزيد من جزيئات المذيبات تتفاعل مع المذاب.
كلما زاد حجم المذيب المستخدم ، زادت سرعة عملية الذوبان.
4. سرعة الخلط
ستكون عملية الذوبان أسرع إذا أضفت عامل التحريك.
عن طريق التحريك ، يتم خلط الجزيئات الذائبة بشكل متزايد مع المذيب بحيث يكون تفاعل الذوبان أسرع من الذوبان دون التقليب.
هذا شرح للحل والذوبان مع المعنى والخصائص والأنواع والعوامل. ربما يكون مفيدا.
