
النظام الدوري للعناصر هو ترتيب يمثل العناصر الكيميائية. عادة ما يتم ترتيب النظام الدوري للعناصر في شكل جدول.
يعتمد ترتيب النظام الدوري للعناصر على الأعداد الذرية ، وتكوينات الإلكترون ، والخصائص الكيميائية.
فيما يلي ترتيب النظام الدوري للعناصر:
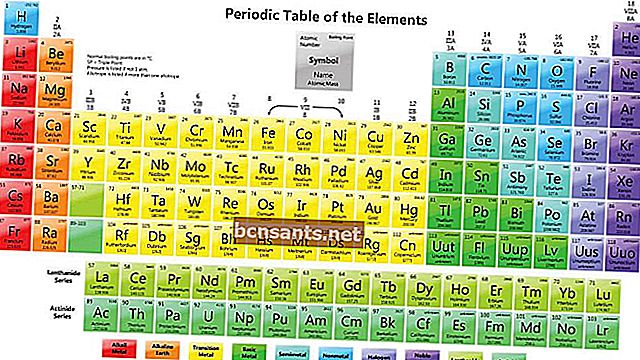
كيف تقرأ العناصر في النظام الدوري للعناصر
في SPU ، ستجد كتابة كل عنصر كما هو موضح أدناه.
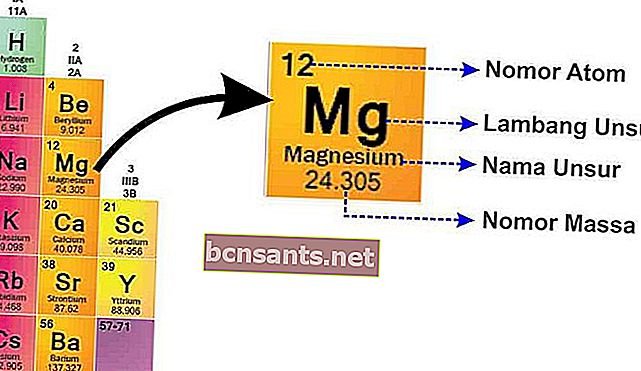
من هذه الصورة يمكن أن توضح:
- العدد الشامل
العدد الكتلي هو نواة الذرة التي لها شحنة موجبة لأن هناك بروتونات موجبة الشحنةو النيوترونات التي هي محايدة
- العدد الذري
يخبرك العدد الذري بعدد البروتونات ، لأن الذرة متعادلة ، والرقم الذري يخبرك أيضًا بعدد الإلكترونات .
تجميع العنصر
في النظام الدوري للعناصر ، يتم تجميع كل عنصر وفقًا لذلك
- مجموعة
المجموعات موجودة في العمود الرأسي لجدول النظام الدوري للعناصر. العناصر الموجودة في نفس المجموعة سيكون لها نفس تكوين إلكترون التكافؤ.

- فترة
الفترات هي العناصر الموجودة في صف أفقي في الجدول الدوري للعناصر. يظهر فترة طاقة التأين ، نصف القطر الذري، الألفة الإلكترونية ، و الكهربية.

- منع
تمثل الكتلة مجموعة من العناصر التي لها نفس القشرة الفرعية لإلكترونات التكافؤ.

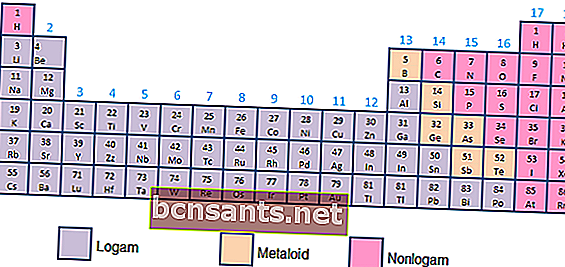
- المعادن والفلزات واللافلزات
بناءً على الخواص الكيميائية والفيزيائية ، يمكن تصنيف العناصر على أنها معادن (موصلية عالية) ، أو أشباه فلزات (موصلية بين المعادن وغير الفلزات) ، أو غير معدنية (ليس لها خصائص التوصيل ، في شكل غازات).
طاقة التأين ونصف القطر الذري وتقارب الإلكترون والسلبية الكهربية
يمكن رؤية طاقة التأين ونصف القطر الذري وتقارب الإلكترون والسلبية الكهربية بناءً على فترات ومجموعات العناصر في النظام الأولي.
اقرأ أيضًا: كيف تتعرف على جثث ضحايا حوادث الطائرات؟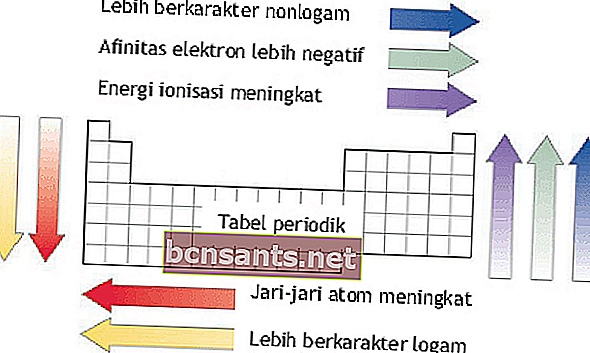
طاقة التأين
طاقة التأين هي الطاقة اللازمة لإزالة أحد الإلكترونات الخارجية من الذرة في الحالة الغازية.
في فترة واحدة ، تزداد طاقة التأين من اليسار إلى اليمين مع زيادة العدد الذري.
داخل المجموعة ، تنخفض طاقات التأين من أعلى إلى أسفل مع زيادة العدد الذري.
نصف القطر الذري
نصف القطر الذري هو المسافة بين النواة والمسار الخارجي للذرة.
في فترة واحدة ، يزيد نصف القطر الذري من أعلى إلى أسفل.
داخل المجموعة ، يزيد نصف القطر الذري من اليمين إلى اليسار.
الإلكترون تقارب
تقارب الإلكترون هو الطاقة التي تطلقها الذرة في حالتها الغازية لتكوين أيونات سالبة.
في فترة واحدة ، يزداد تقارب الإلكترون من الأسفل إلى الأعلى. داخل المجموعة ، يزداد تقارب الإلكترون من اليسار إلى اليمين.
كهرسلبية
الكهربية هي قيمة ميل الذرة لجذب الإلكترونات في تكوين روابط كيميائية. هذه الخاصية مهمة في تكوين الروابط بين الذرات.
في فترة واحدة ، تزداد الكهربية من أسفل إلى أعلى.
في فترة واحدة ، تزداد الكهربية من اليسار إلى اليمين.
مرجع
- الجدول الدوري للعناصر
- //www.studiobelajar.com/sistem-periodic-elements/
