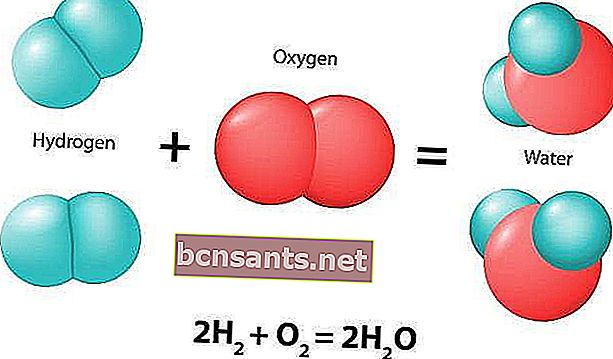
التفاعل الكيميائي هو عملية طبيعية تنتج دائمًا تغييرات في المركبات الكيميائية. يُطلق على المركب الأولي أو المركبات المشاركة في التفاعل المواد المتفاعلة.
تتميز التفاعلات الكيميائية عادة بتغير كيميائي ، وسوف ينتج عنها منتج واحد أو أكثر والتي عادة ما تكون لها خصائص مختلفة عن المواد المتفاعلة. فيما يلي مثال على تفاعل كيميائي:
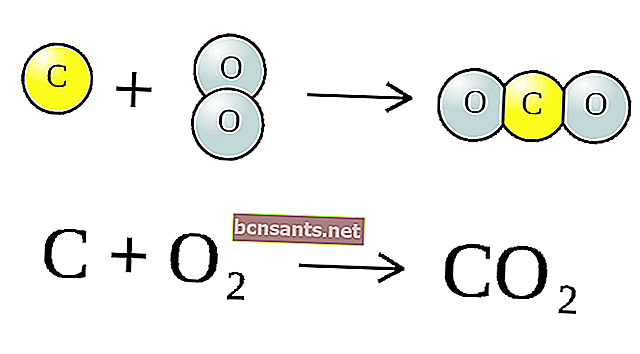
التفاعل الكيميائي أعلاه هو جزيء (CO2) يتكون من ذرة كربون واحدة (C) واثنين من ذرات الأكسجين (O) بالإضافة إلى كربون واحد (C) ، مما ينتج عنه ذرتان من أول أكسيد الكربون (CO).
يُطلق على مجموعة هذه الرموز اسم المعادلة الكيميائية . تسمى المواد الموجودة على يسار السهم لكل تفاعل (CO2) و C ، وبعد الأسهم تسمى نواتج التفاعل ، وهي CO.
خصائص التفاعل الكيميائي
من السهل جدًا العثور على التفاعلات الكيميائية في العالم الحقيقي ، على سبيل المثال عند حرق الورق. الورقة الأولية لا تزال ورقة بيضاء ، بعد حرقها بالنار ، يتم حرق الورق الملون.

الى جانب ذلك ، عندما نغلي الماء. يصبح الماء السائل التالي غازًا وبخار ماء بعد غليه في قدر يوضع على الموقد.
هذه الحوادث هي علامات على تفاعل كيميائي حقيقي. ومع ذلك ، من الصعب للغاية رؤية النتيجة لتشكيل المنتج. فيما يلي خصائص التفاعل الكيميائي:
1 . تلون
الجزيئات / المركبات الكيميائية لها القدرة على امتصاص الألوان وإصدار اللون حسب المواد. يمكن أن تتأثر هذه القدرة أيضًا بحدث ما.
على سبيل المثال: المواد المتفاعلة للحديد التي تُترك في مكان مفتوح لفترة طويلة جدًا وفي حالة رطبة سوف تصدأ (أصفر بني).
2. تغيرات درجة الحرارة
تحتوي الجزيئات / المركبات الكيميائية على طاقة داخلية في شكل روابط كيميائية. تتطلب هذه الروابط طاقة أو يمكنها إطلاق طاقة.
عندما يتم تكوين العديد من الروابط ، يتم إطلاق الطاقة مع زيادة درجة الحرارة. على سبيل المثال: حرق غاز البترول المسال على الموقد
3. ظهور فقاعات الغاز
يمكن أن تحدث الغازات في التفاعلات الكيميائية بسبب التسخين.
على سبيل المثال: جزيئات / مركبات صودا الخبز في العجين عند تسخينها ستطلق الغاز بحيث تتمدد الكعكة.
4. حجم التغيير
عندما تتشكل المنتجات الناتجة عن تفاعل كيميائي ، فإن هذا يعني أن حجم المواد المتفاعلة ينخفض. على سبيل المثال: ينخفض حجم مياه البحيرة خلال فصل الصيف.
5. تشكلت الرواسب
الراسب هو تفاعل كيميائي متبقي بين محلولين يصبحان صلبين. يمكن أن تحدث هذه المادة لأن المحلول مشبع جدًا.
على سبيل المثال: يضاف محلول نترات الفضة (AgNO3) إلى محلول يحتوي على كلوريد البوتاسيوم (KCl) ، وسيتم تكوين راسب أبيض من كلوريد الفضة (AgCl).
6. انبعاث الضوء
تطلق التفاعلات الكيميائية أحيانًا طاقة على شكل ضوء
على سبيل المثال: رد الفعل تجاه الشمس
7. التغييرات في التوصيل
التفاعلات الكيميائية تؤثر على التغيرات في التوصيل (القدرة على توصيل الحرارة).
8. تغيير في الذوق
يخلق التفاعل الكيميائي عند مضغ الأرز طعمًا حلوًا عندما يلمس اللسان.
العوامل المؤثرة

يوضح معدل التفاعل أو السرعة في تفاعل كيميائي عدد التفاعلات الكيميائية التي تحدث لكل وحدة زمنية.
يتأثر هذا المعدل بالعديد من العوامل التي يمكن أن تسرع أو تبطئ عملية التفاعل. ها هي العوامل.
1. قياس المتفاعلات
ملح خشن أو ملح لا يزال قطعًا. يذوب هذا الملح الخشن ببطء شديد في الماء بسبب حجمه الكبير. بحيث يعتمد التفاعل الكيميائي بشكل كبير على حجم المادة.
اقرأ أيضًا: العرض والطلب - التعريف والقوانين والأمثلة2. درجة الحرارة
يمكن أن تؤثر درجة الحرارة على التفاعلات الكيميائية ، أي عن طريق التسخين. على سبيل المثال ، في الصيف ، تحترق غابات الأخشاب بشكل أسرع من موسم الأمطار.
3. محفز
المحفز هو مادة تسرع معدل التفاعلات الكيميائية عند درجة حرارة معينة ، دون حدوث تغييرات أو استخدامها بواسطة التفاعل نفسه. الإنزيمات هي نوع واحد من المحفزات. بدون الإنزيمات ، سيكون هذا التفاعل بطيئًا جدًا بحيث لا يحدث التمثيل الغذائي.
على سبيل المثال ، يقوم إنزيم Maltase بتحويل المالتوز (نوع من عديد السكاريد أو السكر المعقد) إلى جلوكوز ، فيما يلي مخطط عام للتفاعلات التحفيزية ، حيث يمثل C المحفز:
A + C → AC (1)
B + AC → AB + C (2)
مراحل التفاعل الكيميائي
يمكن بسهولة تقسيم مراحل التفاعل إلى:
- إنهاء العلاقات ،
- تشكيل المركبات الانتقالية
- تكوين الرابطة
بالنسبة للمركبات ثنائية الجزيئات ، تكون الخطوات أكثر تعقيدًا بسبب التفاعل العنصري.
- مرحلة بدء التفاعل
- إنهاء العلاقات
- تشكيل المركبات الانتقالية
- تشكيل المنتج
- استقرار الطاقة (عن طريق امتصاص أو إطلاق الطاقة / عادة الحرارة)
متنوع
التفاعلات الكيميائية متنوعة للغاية ، ولكن يمكن تصنيفها إلى عدة أنواع من التفاعلات ، وهي:
1. تفاعل الاندماج
تفاعل المادتين اللتين تتحدان لتكوين مادة جديدة. من الأمثلة السهلة تشكيل ملح كلوريد الصوديوم: 2Na + Cl2 → 2NaCl
2. التحلل رد فعل
المركب الذي يحدث في تفاعل كيميائي ينقسم إلى أكثر من مادتين. مثال على ذلك هو تحلل الماء H2O: 2H2O → 2H2 + O2
3. تفاعل التبادل الفردي
تفاعل التبادل هو تفاعل يتفاعل فيه عنصر مع مركب ليحل محل العناصر الموجودة في هذا المركب. على سبيل المثال ، إذا تم غمر النحاس في محلول نترات الفضة ، يتم إنتاج بلورات الفضة المعدنية. معادلة التفاعل هي:
Cu (s) + 2AgNO 3 (aq) → 2Ag (s) + Cu (NO 3 ) 2 (aq)
4. تفاعلات تبادل متعددة
عادة ما يسمى تفاعل التفاعل الكيميائي مزدوج التبادل ، وهو تفاعل تبادل جزئي للمواد المتفاعلة. إذا كان الكاشف عبارة عن مركب أيوني لورتان ، فإن الأجزاء المتبادلة هي كاتيونات وأنيونات المركب. على سبيل المثال ، تفاعل الأحماض مع قواعد مثل:
HCl (aq) + NaOH (aq) → NaCl (aq) + H 2 O (l)
5. تفاعل الاحتراق
يمكن أن يعرف هذا التفاعل بأنه رد فعل لإعادة ترتيب الذرات. تميز أحد الكواشف بالأكسجين.
بمعنى أن تفاعل الاحتراق هو تفاعل كيميائي لمادة مع الأكسجين ، وعادة ما يتفاعل بشكل أسرع مع إطلاق الحرارة حتى يظهر اللهب. على سبيل المثال حرق الميثان
CH 4 (g) + 2O 2 (g) → CO 2 (g) + 2H 2 O (g)
أمثلة على التفاعلات الكيميائية
هناك الكثير من ردود الفعل التي يمكن العثور عليها في الحياة الواقعية. بعضها متعمد في شكل تدريب عملي في المختبر بحيث يحدث بشكل طبيعي.
قد تتضمن بعض هذه التفاعلات الكيميائية تفاعلات الدمج في منتجات جديدة والاحتراق والتحلل وغيرها. فيما يلي بعض ردود الفعل الشائعة:
1. تكوين الصابون

تفاعل الشتلة هو تفاعل التحلل المائي للدهون / الزيت باستخدام قاعدة قوية مثل NaOH أو KOH لإنتاج أملاح الجلسرين والأحماض الدهنية أو الصابون. يستخدم هيدروكسيد الصوديوم لإنتاج الصابون الصلب ، بينما يستخدم KOH لإنتاج الصابون الناعم أو الصابون السائل.
الفرق بين الصابون الصلب واللين عند رؤيته من قابليتهما للذوبان في الماء هو أن الصابون الصلب أقل قابلية للذوبان في الماء بالمقارنة مع الصابون اللين. يسمى تفاعل التصبن أيضًا تفاعل التصبن.

2. التفاعل الحمضي القاعدي مع الملح
اقرأ أيضًا: 4 مبادئ للجغرافيا وتطبيقاتها في حياتنافي الكيمياء ، الملح مركب أيوني يتكون من أيونات موجبة (كاتيونات) وأيونات سالبة (أنيون) ، مكونًا مركبًا متعادلًا (بدون شحن). يتكون الملح من تفاعل الأحماض والقواعد. يمكن أيضًا أن يتكون الملح من أملحين مختلفين مثل:
Pb (NO 3 ) 2 (aq) + Na 2 SO 4 (aq) → PbSO 4 (s) + 2 NaNO 3 (aq)
3. تفاعل التآكل
التآكل هو الضرر الذي يلحق بالمعدن بسبب تفاعل الأكسدة والاختزال بين المعدن والمواد المختلفة في بيئته والتي تنتج مركبات غير مرغوب فيها.
في عملية التآكل ، يعمل الحديد (Fe) كعامل مختزل ويعمل الأكسجين (O2) المذاب في الماء كمؤكسد. تكون معادلة التفاعل لتكوين الصدأ كما يلي:
Fe ( s ) → Fe2 + ( aq ) + 2e–
O 2 ( g ) + 4H + ( aq) + 4e– → 2H 2 O ( l )
4. تفاعلات التمثيل الضوئي
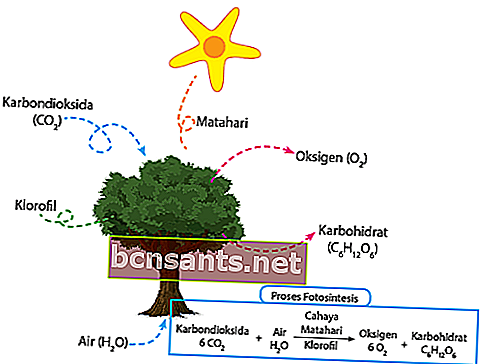
وفقًا لـ KBBI ، فإن عملية التمثيل الضوئي عبارة عن نبات أخضر يستخدم ضوء الشمس لتحويل الماء وثاني أكسيد الكربون إلى كربوهيدرات. يتم امتصاص ثاني أكسيد الكربون الموجود حول النبات مباشرة من خلال نسيج الثغور في الأوراق. يتم امتصاص الماء المحيط بالنبات مباشرة من خلال الجذور ويمرر إلى الأوراق من خلال سيقان النبات.
في وقت الظهيرة ، يلتقط الكلوروفيل شدة الضوء المتساقطة مباشرة من أجل التمثيل الضوئي. الطاقة من ضوء الشمس التي تم التقاطها مسبقًا ، ستحول الماء على الفور إلى أكسجين وهيدروجين.
أخيرًا ، سيتم دمج الهيدروجين الذي تم إنتاجه مباشرة مع ثاني أكسيد الكربون لإنتاج الغذاء لاحتياجات هذه النباتات. الباقي ، سيتم إطلاق الأكسجين مباشرة في الهواء من خلال الثغور. ها هي المعادلة الكيميائية:
6CO2 + 6H2O + ضوء = C6H12O6 + 6O2
5. التفاعلات الكيميائية للخل وصودا الخبز
هل سبق لك أن تعلمت عن التفاعل الكيميائي إذا كان الخل وصودا الخبز يمكن أن يؤديا إلى انفجار لعبة بركان في مدرستك؟
المركبات الحمضية الممزوجة بمركبات قلوية تنتج مركبات محايدة. في التجربة ، تم خلط مركب حمض ضعيف في محلول من حمض الخليك (CH3COOH) مع مركب قاعدي قوي في محلول من صودا الخبز (NaHCO3).

في تفاعل كيميائي ، يمكن تحويل مادة واحدة أو أكثر إلى مواد جديدة ، وفقًا للتجربة ، يتفاعل الخل الحمضي (CH3COOH) مع صودا الخبز (NaHCO3) لإنتاج غاز ثاني أكسيد الكربون.
إذا تفاعل الخل الحمضي (CH3COOH) وصودا الخبز (NaHCO3) ، فسوف ينتج عنه فقاعات تتسبب في تكوين غاز ثاني أكسيد الكربون (CO2). ستتسبب هذه الغازات والسوائل في خروج السوائل مثل الحمم البركانية.
6. التفاعلات الكيميائية الأنزيمية
الإنزيمات عبارة عن جزيئات حيوية في شكل بروتينات تعمل كمحفزات (مركبات تسرع عملية التفاعل دون التفاعل تمامًا) في تفاعل كيميائي عضوي.
على الرغم من أن مركب المحفز يمكن أن يتغير في التفاعل الأولي ، في التفاعل النهائي ستعود جزيئات المحفز إلى شكلها الأصلي. تعمل الإنزيمات من خلال التفاعل مع جزيئات الركيزة لإنتاج مركبات وسيطة من خلال تفاعل عضوي يتطلب طاقة تنشيط أقل ، بحيث تتسارع التفاعلات الكيميائية لأن التفاعلات الكيميائية ذات طاقات التنشيط الأعلى تستغرق وقتًا أطول.
على سبيل المثال: إنزيم الكاتلاز هو إنزيم يحفز تفاعلًا يتم فيه تكسير بيروكسيد الهيدروجين إلى ماء وأكسجين.
